上海邦景实业有限公司
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
全部产品
- 查看全部分类
- 菌种
- ATCC细胞
- elisa检测试剂盒
- 抗体
- 标准品
- 培养基
- 试剂盒
- 生化试剂
- elisa酶联免疫试剂盒
- 科研标准品
- 进口ELISA Kit
- RNA/DNA提取
- Sigma试剂
- 科研抗体
- 标准品、对照品
- 代理品牌
- 生物碱
- 黄酮
- 药物杂质及中间体
- 其它天然产物
- 蒽醌
- 其它醌类
- 甾体
- 查尔酮
- 氧杂蒽酮
- 木脂素
- 其它萜类
- 环烯醚萜
- 倍半萜
- 二萜
- 耗材仪器
- 其它酚类
- 三萜
- 香豆素
- 苯丙素
- 中药对照品
- 检测试剂盒
- PCR检测试剂盒
- 生物学试剂
- 细胞库
- 分析化学
- PCR试剂盒
- 耗材和仪器
- PCR鉴定试剂盒
- 进口抗体
- 原代细胞
- LAMP试剂盒
- 滴定缓冲溶液
- 植物提取对照品
- ELISA Kit
- 进口PCR试剂盒
- 进口ELISA检测试剂盒
- 抑制剂
- 快速检测试剂盒
- 荧光定量染料法PCR试剂盒
- 分子化合物
- PCR相关
- RNA相关产品
- 其他DNA/RNA聚合酶
- 核酸纯化
- PCR及RT-PCR相关
- DNA分子量标准
- 克隆载体及相关产品
- 恒温扩增系列
- 蛋白相关
- 核酸酶系列
- 核酸修饰酶系列
- miRNA检测系列
- 提取试剂盒
- 核酸纯化专题
- ELISA试剂盒
- 细胞系
- 蛋白
推荐产品
公司新闻/正文
聚合酶链式(PCR)反应原理步骤及常见解答
6219 人阅读发布时间:2022-03-28 10:31
PCR 全称多聚酶链式反应(polymerase chain reaction),是一种非常强大的技术,可以通过一种非常简单但是高效的方法来复制 DNA,它可看作是生物体外的特殊 DNA 复制,PCR 的最大特点是是可以以微量的 DNA 为模板,快速扩增得到大量拷贝。
为什么要复制 DNA?DNA 复制是很多研究的基础,例如,当我们对 RNA 进行测序时,必须先将 RNA 转化为 DNA,并进行大量复制。在对于某个人进行基因组测序时,我们不能对于某个细胞或者单个分子进行测序。测序的基础要求拥有大量的相同的 DNA 分子拷贝,因此,DNA 复制是做生物研究中的基础工具。那么怎么获取这么多拷贝呢?PCR 正是一个复印机一般的存在,利用 DNA 的几个特性,成为批量复制 DNA 的极好方法。
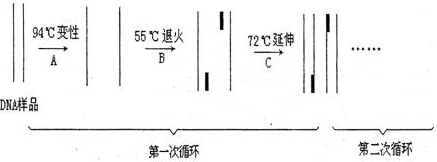
一、实验原理
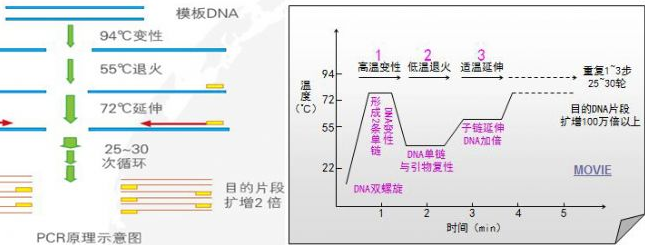
聚合酶链反应 (PCR) 技术是在体外进行的由引物介导的酶促 DNA 扩增反应。PCR 的原理是在模板 DNA、PCR 引物、四种脱氧核糖核苷酸 (dNTP) 及适当浓度的 Mg2+存在的条件下,依赖于 DNA 聚合酶的体外酶促合成反应。两个引物分别位于靶序列两端,同两条模板的 3』端互补,由此限定扩增片段。PCR 反应由一系列的变性→退火→延伸反复循环构成,即在高温下模板双链 DNA 变性解链,然后在较低温度下同过量引物退火,再在适中温度下由 DNA 聚合酶催化进行延伸。理论上,经过 N 次循环可使特定片段扩增到 2n-1,考虑到扩增效率达不到 100%,所以通常经 25 到 30 次循环可扩增到 106 倍,足够后续实验展开。
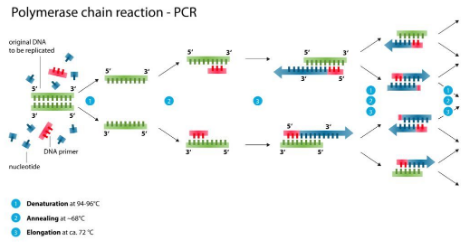
二、反应基本组成
1、DNA 模板(template):含有待扩增的 DNA 片段。
2、2 条引物(primer):决定了需要扩增的起始和终止位置。
3、DNA 聚合酶(polymerase):复制需要扩增的区域,耐高温的 Taq 酶最为常见,其在 DNA 变性过程中仍具活性。
4、4 种脱氧核苷三磷酸(dNTPs):DNA 聚合酶可以从中合成新的 DNA 互补链。
5、含有镁离子的缓冲体系,提供适合聚合酶行使功能的化学环境。
三、反应步骤
1、变性:利用高温(93-98℃)使双链 DNA 解螺旋,高温使两条 DNA 链间的氢键断裂。在第一个循环之前,通常加热时间较长以确保模板 DNA 完全分离,仅以单链形式存在。该步骤时间 1-2 分钟,接下来机器就控制温度进入循环阶段。
2、退火:将反应温度降低至 50-65℃(通常比引物 值低 3-5℃)持续 20-40s,从而使引物结合于单链 DNA 上。若退火温度过低,容易造成非特异扩增,而退火温度过高,引物可能根本不结合。
3、延伸:此步骤的温度取决于所用的 DNA 聚合酶。 Taq(Thermus aquaticus)聚合酶的热稳定 DNA 聚合酶的最佳活性温度约为 75–80°C,但通常使用的延伸温度为 72°C。 在这一步骤中,DNA 聚合酶通过从反应体系中添加的 5' 至 3' 方向的游离 dNTP,从而合成与 DNA 模板链互补的新 DNA 链。延伸所需的精确时间取决于所用的 DNA 聚合酶和待扩增的 DNA 片段的长度。 传统的 Taq 酶估计合成 1000bp 大概需要 1 分钟、较新的 Tbr 酶(来自于嗜热菌 Thermus brockianus)约 40s、商业公司生产的融合型聚合酶仅需约 10-15s。有修正功能的则会比较慢。
上述循环结束后,将进入终延伸阶段:此步骤是可选的,但要在 70-74°C)(PCR 中使用的大多数聚合酶最佳活性所需的温度范围)下进行 5-15 分钟。 最后一个 PCR 循环,以确保所有剩余的单链 DNA 的冈崎片段被补齐。
最终保持:最后一步将 PCR 仪反应室无限期地冷却至 4–15°C,可用于 PCR 产物的短期保存。
四、常见问题分析与解决方法
1. 无扩增条带
1)酶失活或在反应体系中未加入酶。Taq DNA 聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
2)模板含有杂质。特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成 DNA 脱嘌呤而影响 PCR 的结果。
3)变性温度是否准确:PCR 仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
4)反应系统中污染了蛋白酶及核酸酶,应在未加 Taq 酶以前,将反应体系 95℃ 加热 5-10 min。
5)引物变质失效。人工合成的引物是否正确。是否纯化,或因储存条件不当而失活。
6)引物错误。利用 BLAST 检查引物特异性或重新设计引物。
7)DNA 凝胶电泳时加入阳性对照,确保不是 DNA 凝胶和 PCR 程序的问题。
2. PCR 产物量过少
1)退火温度不合适。以 2 度为梯度设计梯度 PCR 反应优化退火温度。
2)DNA 模板量太少。增加 DNA 模板量。
3)PCR 循环数不足。增加反应循环数。
4)引物量不足。增加体系中引物含量。
5)延伸时间太短。以 1 kb/min 的原则设置延伸时间。
6)变性时间过长。变性时间过长会导致 DNA 聚合酶失活。DNA 模板中存在抑制剂。确保 DNA 模板干净。
3. 扩增产物在凝胶中涂布或成片状条带弥散
1)酶量过高。减少酶量;酶的质量差,调换另一来源的酶。
2)dNTP 浓度过高。减少 dNTP 的浓度。
3)MgCl2 浓度过高。可适当降低其用量。
4)模板量过多。质粒 DNA 的用量应 <50 ng,而基因组 DNA 则应 <200 ng。
5)引物浓度不够优化。对引物进行梯度稀释重复 PCR 反应。
6)循环次数过多;增加模板量减少循环次数至 30,缩短退火时间及延伸时间,或改用二种温度的 PCR 循环。
7)退火温度过低。
8)电泳体系有问题:
①凝胶中缓冲液和电泳缓冲液浓度相差太大;
②凝胶没有凝固好;
③琼脂糖质量差。
9)若为 PCR 试剂盒则可能:
① 由于运输储存不当引起试剂盒失效;
② 试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
10)降解的陈旧模板扩增也易产生涂布。
4. 扩增产物出现多条带 (杂带)
1)引物用量偏大,引物的特异性不高。应调换引物或降低引物的使用量。
2)循环的次数过多。适当增加模板的量,减少循环次数。
3)酶的用量偏高或酶的质量不好,应降低酶量或调换另一来源的酶。
4)退火温度偏低,退火及延伸时间偏长。应提高退火温度,减少变性与延伸时间,也可采用二种温度的 PCR 扩增。以 2 度为梯度设计梯度 PCR 反应优化退火温度。
5)样品处理不当。
6)Mg2+浓度偏高,因适当调整 Mg2+使用浓度。
7)若为 PCR 试剂盒,也可能时试剂盒本身质量有问题。
8)复制提前终止。使用非热启动的聚合酶时常有发生。冰上准备反应体系或采用热启动聚合酶。
9)反应缓冲液未完全融化或未充分混匀。确保反应缓冲液融化完全并彻底混匀。
10)引物特异性差。利用 BLAST 检查引物特异性或重新设计引物。
11)引物量过多。减少反应体系中引物的用量。
12)模板量过多。质粒 DNA 的用量应 <50ng,而基因组 DNA 则应 <200ng。
13)外源 DNA 污染。确保操作的洁净。
5. 阴性对照出现条带
试剂,枪头,工作台污染。使用全新的试剂和枪头,对工作台进行清洁。
6. 条带大小与理论不符
1)污染。使用全新的试剂和枪头,对工作台进行清洁。
2)模板或引物使用错误。更换引物和模板。
3)基因亚型。对研究的基因进行序列分析和 BLAST 研究。
为什么要复制 DNA?DNA 复制是很多研究的基础,例如,当我们对 RNA 进行测序时,必须先将 RNA 转化为 DNA,并进行大量复制。在对于某个人进行基因组测序时,我们不能对于某个细胞或者单个分子进行测序。测序的基础要求拥有大量的相同的 DNA 分子拷贝,因此,DNA 复制是做生物研究中的基础工具。那么怎么获取这么多拷贝呢?PCR 正是一个复印机一般的存在,利用 DNA 的几个特性,成为批量复制 DNA 的极好方法。

一、实验原理
聚合酶链反应 (PCR) 技术是在体外进行的由引物介导的酶促 DNA 扩增反应。PCR 的原理是在模板 DNA、PCR 引物、四种脱氧核糖核苷酸 (dNTP) 及适当浓度的 Mg2+存在的条件下,依赖于 DNA 聚合酶的体外酶促合成反应。两个引物分别位于靶序列两端,同两条模板的 3』端互补,由此限定扩增片段。PCR 反应由一系列的变性→退火→延伸反复循环构成,即在高温下模板双链 DNA 变性解链,然后在较低温度下同过量引物退火,再在适中温度下由 DNA 聚合酶催化进行延伸。理论上,经过 N 次循环可使特定片段扩增到 2n-1,考虑到扩增效率达不到 100%,所以通常经 25 到 30 次循环可扩增到 106 倍,足够后续实验展开。

二、反应基本组成
1、DNA 模板(template):含有待扩增的 DNA 片段。
2、2 条引物(primer):决定了需要扩增的起始和终止位置。
3、DNA 聚合酶(polymerase):复制需要扩增的区域,耐高温的 Taq 酶最为常见,其在 DNA 变性过程中仍具活性。
4、4 种脱氧核苷三磷酸(dNTPs):DNA 聚合酶可以从中合成新的 DNA 互补链。
5、含有镁离子的缓冲体系,提供适合聚合酶行使功能的化学环境。
三、反应步骤
1、变性:利用高温(93-98℃)使双链 DNA 解螺旋,高温使两条 DNA 链间的氢键断裂。在第一个循环之前,通常加热时间较长以确保模板 DNA 完全分离,仅以单链形式存在。该步骤时间 1-2 分钟,接下来机器就控制温度进入循环阶段。
2、退火:将反应温度降低至 50-65℃(通常比引物 值低 3-5℃)持续 20-40s,从而使引物结合于单链 DNA 上。若退火温度过低,容易造成非特异扩增,而退火温度过高,引物可能根本不结合。
3、延伸:此步骤的温度取决于所用的 DNA 聚合酶。 Taq(Thermus aquaticus)聚合酶的热稳定 DNA 聚合酶的最佳活性温度约为 75–80°C,但通常使用的延伸温度为 72°C。 在这一步骤中,DNA 聚合酶通过从反应体系中添加的 5' 至 3' 方向的游离 dNTP,从而合成与 DNA 模板链互补的新 DNA 链。延伸所需的精确时间取决于所用的 DNA 聚合酶和待扩增的 DNA 片段的长度。 传统的 Taq 酶估计合成 1000bp 大概需要 1 分钟、较新的 Tbr 酶(来自于嗜热菌 Thermus brockianus)约 40s、商业公司生产的融合型聚合酶仅需约 10-15s。有修正功能的则会比较慢。
上述循环结束后,将进入终延伸阶段:此步骤是可选的,但要在 70-74°C)(PCR 中使用的大多数聚合酶最佳活性所需的温度范围)下进行 5-15 分钟。 最后一个 PCR 循环,以确保所有剩余的单链 DNA 的冈崎片段被补齐。
最终保持:最后一步将 PCR 仪反应室无限期地冷却至 4–15°C,可用于 PCR 产物的短期保存。

四、常见问题分析与解决方法
1. 无扩增条带
1)酶失活或在反应体系中未加入酶。Taq DNA 聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
2)模板含有杂质。特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成 DNA 脱嘌呤而影响 PCR 的结果。
3)变性温度是否准确:PCR 仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
4)反应系统中污染了蛋白酶及核酸酶,应在未加 Taq 酶以前,将反应体系 95℃ 加热 5-10 min。
5)引物变质失效。人工合成的引物是否正确。是否纯化,或因储存条件不当而失活。
6)引物错误。利用 BLAST 检查引物特异性或重新设计引物。
7)DNA 凝胶电泳时加入阳性对照,确保不是 DNA 凝胶和 PCR 程序的问题。
2. PCR 产物量过少
1)退火温度不合适。以 2 度为梯度设计梯度 PCR 反应优化退火温度。
2)DNA 模板量太少。增加 DNA 模板量。
3)PCR 循环数不足。增加反应循环数。
4)引物量不足。增加体系中引物含量。
5)延伸时间太短。以 1 kb/min 的原则设置延伸时间。
6)变性时间过长。变性时间过长会导致 DNA 聚合酶失活。DNA 模板中存在抑制剂。确保 DNA 模板干净。
3. 扩增产物在凝胶中涂布或成片状条带弥散
1)酶量过高。减少酶量;酶的质量差,调换另一来源的酶。
2)dNTP 浓度过高。减少 dNTP 的浓度。
3)MgCl2 浓度过高。可适当降低其用量。
4)模板量过多。质粒 DNA 的用量应 <50 ng,而基因组 DNA 则应 <200 ng。
5)引物浓度不够优化。对引物进行梯度稀释重复 PCR 反应。
6)循环次数过多;增加模板量减少循环次数至 30,缩短退火时间及延伸时间,或改用二种温度的 PCR 循环。
7)退火温度过低。
8)电泳体系有问题:
①凝胶中缓冲液和电泳缓冲液浓度相差太大;
②凝胶没有凝固好;
③琼脂糖质量差。
9)若为 PCR 试剂盒则可能:
① 由于运输储存不当引起试剂盒失效;
② 试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
10)降解的陈旧模板扩增也易产生涂布。
4. 扩增产物出现多条带 (杂带)
1)引物用量偏大,引物的特异性不高。应调换引物或降低引物的使用量。
2)循环的次数过多。适当增加模板的量,减少循环次数。
3)酶的用量偏高或酶的质量不好,应降低酶量或调换另一来源的酶。
4)退火温度偏低,退火及延伸时间偏长。应提高退火温度,减少变性与延伸时间,也可采用二种温度的 PCR 扩增。以 2 度为梯度设计梯度 PCR 反应优化退火温度。
5)样品处理不当。
6)Mg2+浓度偏高,因适当调整 Mg2+使用浓度。
7)若为 PCR 试剂盒,也可能时试剂盒本身质量有问题。
8)复制提前终止。使用非热启动的聚合酶时常有发生。冰上准备反应体系或采用热启动聚合酶。
9)反应缓冲液未完全融化或未充分混匀。确保反应缓冲液融化完全并彻底混匀。
10)引物特异性差。利用 BLAST 检查引物特异性或重新设计引物。
11)引物量过多。减少反应体系中引物的用量。
12)模板量过多。质粒 DNA 的用量应 <50ng,而基因组 DNA 则应 <200ng。
13)外源 DNA 污染。确保操作的洁净。
5. 阴性对照出现条带
试剂,枪头,工作台污染。使用全新的试剂和枪头,对工作台进行清洁。
6. 条带大小与理论不符
1)污染。使用全新的试剂和枪头,对工作台进行清洁。
2)模板或引物使用错误。更换引物和模板。
3)基因亚型。对研究的基因进行序列分析和 BLAST 研究。