上海邦景实业有限公司
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
全部产品
- 查看全部分类
- 菌种
- ATCC细胞
- elisa检测试剂盒
- 抗体
- 标准品
- 培养基
- 试剂盒
- 生化试剂
- elisa酶联免疫试剂盒
- 科研标准品
- 进口ELISA Kit
- RNA/DNA提取
- Sigma试剂
- 科研抗体
- 标准品、对照品
- 代理品牌
- 生物碱
- 黄酮
- 药物杂质及中间体
- 其它天然产物
- 蒽醌
- 其它醌类
- 甾体
- 查尔酮
- 氧杂蒽酮
- 木脂素
- 其它萜类
- 环烯醚萜
- 倍半萜
- 二萜
- 耗材仪器
- 其它酚类
- 三萜
- 香豆素
- 苯丙素
- 中药对照品
- 检测试剂盒
- PCR检测试剂盒
- 生物学试剂
- 细胞库
- 分析化学
- PCR试剂盒
- 耗材和仪器
- PCR鉴定试剂盒
- 进口抗体
- 原代细胞
- LAMP试剂盒
- 滴定缓冲溶液
- 植物提取对照品
- ELISA Kit
- 进口PCR试剂盒
- 进口ELISA检测试剂盒
- 抑制剂
- 快速检测试剂盒
- 荧光定量染料法PCR试剂盒
- 分子化合物
- PCR相关
- RNA相关产品
- 其他DNA/RNA聚合酶
- 核酸纯化
- PCR及RT-PCR相关
- DNA分子量标准
- 克隆载体及相关产品
- 恒温扩增系列
- 蛋白相关
- 核酸酶系列
- 核酸修饰酶系列
- miRNA检测系列
- 提取试剂盒
- 核酸纯化专题
- ELISA试剂盒
- 细胞系
- 蛋白
推荐产品
公司新闻/正文
HE染色试验过程问题解答
1336 人阅读发布时间:2022-10-06 15:48
实验原理:
脱氧核糖核酸(DNA)两条链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏mu精碱性染料以离子键结合而被染色。苏mu精在碱性溶液中呈蓝色,所以细胞核被染成蓝色。曙红Y是一种化学合成的酸性染料,在水中离解成带负电荷的阴离子,与蛋白质的氨基正电荷的阳离子结合使胞浆染色,细胞浆、红细胞、肌肉、结缔组织、嗜伊红颗粒等被染成不同程度的红色或粉红色,与蓝色的细胞核形成鲜明对比。伊红是细胞浆的良好染料。
由于组织或细胞的不同成分对苏mu精的亲和力不同及染色性质不一样。经苏mu精染色后,细胞核及钙盐粘液等呈蓝色,可用盐酸酒精分化和弱碱性溶液显蓝,如处理适宜,可使细胞核着清楚的深蓝色,胞浆等其它成分脱色。再利用胞浆染料伊红染胞浆,使胞浆的各种不同成分又呈现出深浅不同的粉红色。故各种组织或细胞成分与病变的一般形态结构特点均可显示出来。
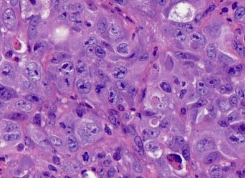
染色试验过程问题解答:
1. 切片在脱蜡后出现大片白色的斑点
原因:由于烤(烘)片温度太低,玻片在脱蜡前没有充分烤(烘)干;切片在二甲ben停留时间不足,或二甲ben使用过久,造成脱蜡不尽。
对策:如果玻片是由于没有烤(烘),先用无水乙醇处理去除玻片上的水分,然后重新用二甲ben脱去石蜡。如果烤(烘)干不足的现象比较严重,可能导致切片脱落,则无法补救。如果白色斑点是由于切片在二甲ben停留时间不足造成,或使用的二甲ben过久,切片则需退回到二甲ben停留时间相对长些,或更换二甲ben,脱色、漂白、重新染色。
2. 细胞核染色苍白、暗淡,即苏mu精染色太淡
原因:此类问题可能有3个影响因素,切片在苏mu精染色液停留时间太短;苏mu精染色液过度氧化,失去染色能力,不能再继续使用;分化步骤处理时间过长。如果是骨组织细胞核暗淡,则多数是由于脱钙过度造成。
对策:切片重新染色。如果组织在酸性固定液如Zenker、Bouin及非中性缓冲甲醛液固定时间过长,细胞核染色能力将减弱,须增加其在苏mu精染色液的时间,或用一些方法增加组织的嗜碱性,以改善细胞核的着色。例如:建议上述组织切片最好使用Weigert铁苏mu精染色液;如果组织是用Zenker液固定的,可将切片脱蜡后放在5%碳酸氢钠溶液3~4 h,流水冲洗5 min后染色;如果组织是用Bouin液固定的,可将切片脱蜡后放在5%碳酸锂1 h,流水冲洗10 min后染色。
3. 细胞核过染,即苏mu精染色太深,甚至苏mu精染液的分布占据了细胞质的位置
原因:此类问题可能有3个影响因素,即切片在苏mu精染色液停留过长、切片太厚、分化步骤时间太短。
对策:如果切片不是因为太厚(用显微镜仔细上下调节微调,只有一二层细胞核层次) ,脱色、漂白、重新染色,对于染色和分化时间做些适当的调整。如果确定是由于切片太厚导致的细胞核过染,则需要重新切片。
4. 细胞核呈红、棕色改变
原因:主要有苏mu精染色液过度氧化和切片在苏mu精染液染色后返蓝不足。
对策:首先,每次染色之前检查苏mu精染色液的染色能力,发现氧化过度应及时更换。其次,可用流水、温水或弱碱性溶液如稀an 水、0. 2%碳酸氢钠等,在苏mu精染色后,给切片以足够的蓝化时间。
5. 伊红着色淡
原因:伊红染液的pH值可能大于5;也可能是蓝化液残留过多;切片太薄;或切片经伊红染色后在乙醇脱水时间过长。
对策:检查伊红染液的pH值,如果必要的话,用乙酸将其调节在4.16~5.10之间,从而使伊红染色色彩艳丽。确保每次蓝化步骤完成后,使用的弱碱性溶液被充分洗去,玻片上没有残留的弱碱性溶液。检查切片的厚度。脱水时不要让切片在低浓度乙醇停留时间过长,因为含水多的低浓度乙醇会将伊红的颜色分化掉。
6. 细胞质过染、分色不足
原因:伊红染色液浓度太高,特别是焰红燃料、四溴四氯荧光素钠的存在;切片在伊红染色时间过长;切片在伊红染色后经乙醇脱水步骤时过的太快,而使乙醇分化伊红的作用不能产生。
对策:适当稀释伊红染色液,减少伊红染色时间,或者使切片在乙醇脱水等步骤时,停留时间相对均匀。同样,也要检查切片的厚度是否合适。
7. 切片中出现蓝黑色沉淀物
原因:苏mu 精染色液中的金属膜,黏附在玻片上。
对策:每天染色前仔细过滤苏mu精染色液,或建议使用半氧化苏mu精染色液,如Gill苏mu精染色液,可以避免过多的金属膜产生。
8. 显微镜下见切片内有大量水珠
原因:切片经梯度乙醇处理后没有完全脱水,导致二甲ben透明中性树胶封固后残留大量水分。
对策:移去盖玻片,用二甲ben溶解封固剂如中性树胶。将切片置入新鲜的无水乙醇换几道。待切片重新脱水完全后,用新二甲ben透明,中性树胶封固。所有用于脱水和透明的液体,在使用一定时间以后,应即时更换。
9. 光镜下切片某些区域难以聚焦
原因:盖玻片上可能有封固切片的封固剂。
对策:移去盖玻片,重新用干净的盖玻片封片。检查切片封片方法,是人工手工封法,还是机器自动封法,如有问题及时调整。
10. 封固剂从盖玻片与载玻片之间的缝隙回缩
原因:盖玻片弯曲或不平整;封固剂含二甲ben过多,稀释过度。
对策:移去盖玻片,重新找一张盖玻片,用干净的封固剂封片。如用手工封片法,每天保证盛装封固剂的容器,在封固结束的时候盖紧盖子。尽量使用小的容器盛装封固剂,一旦封固剂太粘稠,就可以废弃不再使用。
11. 切片从脱蜡的二甲ben经过梯度乙醇进入水溶液时,水和玻片呈现乳白色混浊改变
原因:用于脱蜡的二甲ben没有被乙醇洗干净。
对策:更换洗涤二甲ben的乙醇液体,把切片重新放回无水乙醇,脱去玻片上的水分。
12. 细胞核灰蓝
原因:可能的原因是由于组织处理温度过高、过热,在石蜡停留的时间过长;或者固定时间太短,接下来就直接在高浓度的乙醇中行脱水处理。
对策:理论上来说,加热处理仅在组织浸蜡步骤才使用,组织不能在热的蜡液中停留过长时间。如果由于某些原因不能进行下步包埋处理,完成浸蜡处理后的组织,可将组织连同塑料包埋盒一并放置在室温空气中,冷却凝固,以备包埋。待需要包埋时再重新加温直至石蜡融化即可。组织在处理前必须确保固定良好,脱水最好能从低浓度的乙醇开始。
13. HE染色不规则或不均匀,从小斑点到大面积区域, 散布切片各处,细胞核染色质不够细致
原因:由于使用密闭式组织处理机故障,如密闭不严,导致组织浸蜡时含有水和(或)固定剂。
对策:如果使用开放式组织处理模式,在相对湿度较高的地方,用甲ben替代二甲ben。如果使用密闭式组织处理模式,经常仔细检查仪器设备的各项功能是否完好,一旦发现密闭垫圈老化,应及时更换。
14. 细胞核和细胞质着色深,呈强嗜碱性,特别是在组织的边缘
原因:因激光或电切技术,导致大体组织标本变性,通常使得细胞核和细胞质被深染呈强嗜碱性着色。
对策:目前还没有针对这一人为改变的有效方法。
15. 切片中出现类似色素样的点状结晶和黑色光滑的细胞核俗称裸核改变
原因:切片封片前放置在空气中时间太长,以至于二甲ben挥发切片干燥所致。
对策:移去组织切片上的盖玻片和封固剂,重新处理。将切片水洗数分钟,然后重新脱水、透明、封固。封片过程中要保持组织切片的轻度湿润。
脱氧核糖核酸(DNA)两条链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏mu精碱性染料以离子键结合而被染色。苏mu精在碱性溶液中呈蓝色,所以细胞核被染成蓝色。曙红Y是一种化学合成的酸性染料,在水中离解成带负电荷的阴离子,与蛋白质的氨基正电荷的阳离子结合使胞浆染色,细胞浆、红细胞、肌肉、结缔组织、嗜伊红颗粒等被染成不同程度的红色或粉红色,与蓝色的细胞核形成鲜明对比。伊红是细胞浆的良好染料。
由于组织或细胞的不同成分对苏mu精的亲和力不同及染色性质不一样。经苏mu精染色后,细胞核及钙盐粘液等呈蓝色,可用盐酸酒精分化和弱碱性溶液显蓝,如处理适宜,可使细胞核着清楚的深蓝色,胞浆等其它成分脱色。再利用胞浆染料伊红染胞浆,使胞浆的各种不同成分又呈现出深浅不同的粉红色。故各种组织或细胞成分与病变的一般形态结构特点均可显示出来。

染色试验过程问题解答:
1. 切片在脱蜡后出现大片白色的斑点
原因:由于烤(烘)片温度太低,玻片在脱蜡前没有充分烤(烘)干;切片在二甲ben停留时间不足,或二甲ben使用过久,造成脱蜡不尽。
对策:如果玻片是由于没有烤(烘),先用无水乙醇处理去除玻片上的水分,然后重新用二甲ben脱去石蜡。如果烤(烘)干不足的现象比较严重,可能导致切片脱落,则无法补救。如果白色斑点是由于切片在二甲ben停留时间不足造成,或使用的二甲ben过久,切片则需退回到二甲ben停留时间相对长些,或更换二甲ben,脱色、漂白、重新染色。
2. 细胞核染色苍白、暗淡,即苏mu精染色太淡
原因:此类问题可能有3个影响因素,切片在苏mu精染色液停留时间太短;苏mu精染色液过度氧化,失去染色能力,不能再继续使用;分化步骤处理时间过长。如果是骨组织细胞核暗淡,则多数是由于脱钙过度造成。
对策:切片重新染色。如果组织在酸性固定液如Zenker、Bouin及非中性缓冲甲醛液固定时间过长,细胞核染色能力将减弱,须增加其在苏mu精染色液的时间,或用一些方法增加组织的嗜碱性,以改善细胞核的着色。例如:建议上述组织切片最好使用Weigert铁苏mu精染色液;如果组织是用Zenker液固定的,可将切片脱蜡后放在5%碳酸氢钠溶液3~4 h,流水冲洗5 min后染色;如果组织是用Bouin液固定的,可将切片脱蜡后放在5%碳酸锂1 h,流水冲洗10 min后染色。
3. 细胞核过染,即苏mu精染色太深,甚至苏mu精染液的分布占据了细胞质的位置
原因:此类问题可能有3个影响因素,即切片在苏mu精染色液停留过长、切片太厚、分化步骤时间太短。
对策:如果切片不是因为太厚(用显微镜仔细上下调节微调,只有一二层细胞核层次) ,脱色、漂白、重新染色,对于染色和分化时间做些适当的调整。如果确定是由于切片太厚导致的细胞核过染,则需要重新切片。
4. 细胞核呈红、棕色改变
原因:主要有苏mu精染色液过度氧化和切片在苏mu精染液染色后返蓝不足。
对策:首先,每次染色之前检查苏mu精染色液的染色能力,发现氧化过度应及时更换。其次,可用流水、温水或弱碱性溶液如稀an 水、0. 2%碳酸氢钠等,在苏mu精染色后,给切片以足够的蓝化时间。
5. 伊红着色淡
原因:伊红染液的pH值可能大于5;也可能是蓝化液残留过多;切片太薄;或切片经伊红染色后在乙醇脱水时间过长。
对策:检查伊红染液的pH值,如果必要的话,用乙酸将其调节在4.16~5.10之间,从而使伊红染色色彩艳丽。确保每次蓝化步骤完成后,使用的弱碱性溶液被充分洗去,玻片上没有残留的弱碱性溶液。检查切片的厚度。脱水时不要让切片在低浓度乙醇停留时间过长,因为含水多的低浓度乙醇会将伊红的颜色分化掉。
6. 细胞质过染、分色不足
原因:伊红染色液浓度太高,特别是焰红燃料、四溴四氯荧光素钠的存在;切片在伊红染色时间过长;切片在伊红染色后经乙醇脱水步骤时过的太快,而使乙醇分化伊红的作用不能产生。
对策:适当稀释伊红染色液,减少伊红染色时间,或者使切片在乙醇脱水等步骤时,停留时间相对均匀。同样,也要检查切片的厚度是否合适。
7. 切片中出现蓝黑色沉淀物
原因:苏mu 精染色液中的金属膜,黏附在玻片上。
对策:每天染色前仔细过滤苏mu精染色液,或建议使用半氧化苏mu精染色液,如Gill苏mu精染色液,可以避免过多的金属膜产生。
8. 显微镜下见切片内有大量水珠
原因:切片经梯度乙醇处理后没有完全脱水,导致二甲ben透明中性树胶封固后残留大量水分。
对策:移去盖玻片,用二甲ben溶解封固剂如中性树胶。将切片置入新鲜的无水乙醇换几道。待切片重新脱水完全后,用新二甲ben透明,中性树胶封固。所有用于脱水和透明的液体,在使用一定时间以后,应即时更换。
9. 光镜下切片某些区域难以聚焦
原因:盖玻片上可能有封固切片的封固剂。
对策:移去盖玻片,重新用干净的盖玻片封片。检查切片封片方法,是人工手工封法,还是机器自动封法,如有问题及时调整。
10. 封固剂从盖玻片与载玻片之间的缝隙回缩
原因:盖玻片弯曲或不平整;封固剂含二甲ben过多,稀释过度。
对策:移去盖玻片,重新找一张盖玻片,用干净的封固剂封片。如用手工封片法,每天保证盛装封固剂的容器,在封固结束的时候盖紧盖子。尽量使用小的容器盛装封固剂,一旦封固剂太粘稠,就可以废弃不再使用。
11. 切片从脱蜡的二甲ben经过梯度乙醇进入水溶液时,水和玻片呈现乳白色混浊改变
原因:用于脱蜡的二甲ben没有被乙醇洗干净。
对策:更换洗涤二甲ben的乙醇液体,把切片重新放回无水乙醇,脱去玻片上的水分。
12. 细胞核灰蓝
原因:可能的原因是由于组织处理温度过高、过热,在石蜡停留的时间过长;或者固定时间太短,接下来就直接在高浓度的乙醇中行脱水处理。
对策:理论上来说,加热处理仅在组织浸蜡步骤才使用,组织不能在热的蜡液中停留过长时间。如果由于某些原因不能进行下步包埋处理,完成浸蜡处理后的组织,可将组织连同塑料包埋盒一并放置在室温空气中,冷却凝固,以备包埋。待需要包埋时再重新加温直至石蜡融化即可。组织在处理前必须确保固定良好,脱水最好能从低浓度的乙醇开始。
13. HE染色不规则或不均匀,从小斑点到大面积区域, 散布切片各处,细胞核染色质不够细致
原因:由于使用密闭式组织处理机故障,如密闭不严,导致组织浸蜡时含有水和(或)固定剂。
对策:如果使用开放式组织处理模式,在相对湿度较高的地方,用甲ben替代二甲ben。如果使用密闭式组织处理模式,经常仔细检查仪器设备的各项功能是否完好,一旦发现密闭垫圈老化,应及时更换。
14. 细胞核和细胞质着色深,呈强嗜碱性,特别是在组织的边缘
原因:因激光或电切技术,导致大体组织标本变性,通常使得细胞核和细胞质被深染呈强嗜碱性着色。
对策:目前还没有针对这一人为改变的有效方法。
15. 切片中出现类似色素样的点状结晶和黑色光滑的细胞核俗称裸核改变
原因:切片封片前放置在空气中时间太长,以至于二甲ben挥发切片干燥所致。
对策:移去组织切片上的盖玻片和封固剂,重新处理。将切片水洗数分钟,然后重新脱水、透明、封固。封片过程中要保持组织切片的轻度湿润。