上海邦景实业有限公司
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
全部产品
- 查看全部分类
- 菌种
- ATCC细胞
- elisa检测试剂盒
- 抗体
- 标准品
- 培养基
- 试剂盒
- 生化试剂
- elisa酶联免疫试剂盒
- 科研标准品
- 进口ELISA Kit
- RNA/DNA提取
- Sigma试剂
- 科研抗体
- 标准品、对照品
- 代理品牌
- 生物碱
- 黄酮
- 药物杂质及中间体
- 其它天然产物
- 蒽醌
- 其它醌类
- 甾体
- 查尔酮
- 氧杂蒽酮
- 木脂素
- 其它萜类
- 环烯醚萜
- 倍半萜
- 二萜
- 耗材仪器
- 其它酚类
- 三萜
- 香豆素
- 苯丙素
- 中药对照品
- 检测试剂盒
- PCR检测试剂盒
- 生物学试剂
- 细胞库
- 分析化学
- PCR试剂盒
- 耗材和仪器
- PCR鉴定试剂盒
- 进口抗体
- 原代细胞
- LAMP试剂盒
- 滴定缓冲溶液
- 植物提取对照品
- ELISA Kit
- 进口PCR试剂盒
- 进口ELISA检测试剂盒
- 抑制剂
- 快速检测试剂盒
- 荧光定量染料法PCR试剂盒
- 分子化合物
- PCR相关
- RNA相关产品
- 其他DNA/RNA聚合酶
- 核酸纯化
- PCR及RT-PCR相关
- DNA分子量标准
- 克隆载体及相关产品
- 恒温扩增系列
- 蛋白相关
- 核酸酶系列
- 核酸修饰酶系列
- miRNA检测系列
- 提取试剂盒
- 核酸纯化专题
- ELISA试剂盒
- 细胞系
- 蛋白
推荐产品
公司新闻/正文
甲型流感H1N1亚型病毒核酸检测试剂盒(荧光PCR法)实验说明
783 人阅读发布时间:2024-07-30 16:23
【预期用途】
本试剂盒用于对人咽拭子样本中甲型流感H1N1亚型病毒核酸进行定性检测。检测结果仅供临床参考,不能单独作为确诊或排除病例的依据。
流感病毒属于正黏病毒科的流感病毒属,依据内部核蛋白与基质蛋白的抗原性差异,可被分为甲、乙、丙三型(即A、B、C 三型)。据病毒颗粒外膜血凝素(HA)和神经氨酸酶(NA)蛋白抗原性的不同,甲型流感病毒可分为16 个H 亚型(H1~H16)和9 个N 亚型(N1~N9)。其中甲型H1N1流行性感冒(流感)是由一种新的流感病毒引起的急性呼吸道传染病, 临床主要表现为流感样症状, 包括发热、流涕、咽痛、咳嗽、头痛和腹泻等。
【检验原理】
本试剂盒选用甲型流感H1N1亚型病毒保守基因片段设计特异引物及特异探针,该探针能与引物扩增区域中间的一段DNA模板发生特异性结合,在PCR延伸反应过程中,Taq酶的外切酶活性将5’端荧光基团从探针上切割下来,使之游离于反应体系中,从而脱离了3’端荧光淬灭基团的屏蔽,即能接受光刺激而发出可供仪器检测的荧光,从而实现在全封闭反应体系中对甲型流感H1N1亚型病毒核酸的自动化检测。
试剂盒中的内标选用一对管家基因特异性引物,结合特异性探针,该探针能与引物扩增区域中间的一段DNA模板发生特异性结合,内标选用CY5通道,从而实现在全封闭反应体系中对检测过程的监控,可有效监控假阴性的发生。
【检验方法】
1. 甲型流感H1N1亚型病毒RNA检测试剂盒可兼容常规RNA提取试剂盒或常规RNA提取方法从待测样本中制备的合格的RNA。制备的RNA可直接作为RNA样品,加入PCR反应体系中。
2. 试剂配制【试剂准备区】
从试剂盒中取出H1N1反应混合液,在室温下融化并振荡混匀后,2000rpm离心10sec,按15μl量分装到PCR反应管中,转移至样本处理区。(注:每次实验必须带阴阳性质控)
3. 加样【样本处理区】
分别加入10 μl的阴性对照、H1N1阳性对照(无需抽提)、样品核酸提取产物,终体积为25μl/管,盖紧反应管,瞬时低速离心,转移至检测区。
4. PCR扩增及荧光检测【PCR检测区】
将各反应管按一定顺序放入PCR仪上,按以下程序进行PCR扩增:
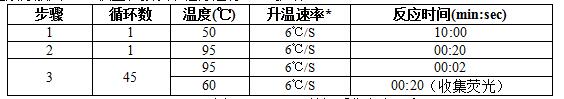
检测荧光选择: H1(FAM),N1(HEX/VIC),内标(CY5),数据采集定在60℃。
*:升温速率6℃/S建议使用抚生系列实时荧光PCR仪,其它仪器根据仪器具体性能选择。
**:其它仪器比如ABI7500采集荧光设定为31s,对结果无影响。
【检验结果的解释】
质量控制
1. 阴性对照:无典型S型扩增曲线。
2. 阳性对照:目标基因通道呈典型S型扩增曲线且Ct值≤30。
3. 在同时满足1、2的条件下,实验有效,否则无效。
结果判读
在满足以上质量控制条件,进行如下分析(FAM通道为H1,HEX/VIC通道为N1,CY5通道为内标):
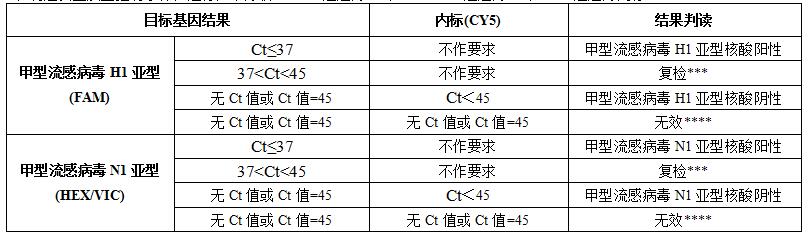
待测标本检测结果37<Ct<45,此时样本应进行重复检测,如重复检测结果Ct值小于45,曲线呈S型且有明显指数增长期,则判断为阳性,否则判断为阴性。
该测试为无效测试,需要排查原因并重新检测。
【检验方法的局限性】
检测结果不能直接作为临床确诊或排除病例的依据,仅供临床医生参考使用。同时,检测结果和样本的采集、保存及运输条件有关,其中任何环节失误都可导致假阴性结果;如在样本处理过程中发生交叉污染,则可能出现假阳性结果。
【性能指标】
1. 检测限:本试剂盒检测限为500copies/ml。
2. 精密度:两例高、低阳性的样本连续重复10次检测,其Ct值的CV≤5%。
3. 特异性:与其感染部位相同或感染症状相似且常见的其他病原体以及人基因组无交叉反应。
【注意事项】
1. 本试剂盒为体外检测试剂,在使用时操作人员必须经过基因扩增或分子生物学方法检测的专业培训,具有相关的实验操作资格,且其所在实验室应具备合理的生物安全防备设施及防护程序。
2. 为保证实验结果的准确性和可靠性请使用已校准的移液器,选用合格的一次性使用的PCR反应管、离心管、枪头等进行样本处理及配液等操作,所有用具应不含DNA 酶和RNA 酶。
3. 实验请严格分区操作:
第一区:试剂准备区-准备扩增所需试剂;第二区:样本处理区-待检测样本和对照品的处理;第三区:PCR检测区-PCR扩增检测,各区物品均为专用,不得交换使用,避免污染,每次实验完后立即清洁工作台。
4. 本产品使用前应在室温充分融化,混匀并瞬时低速离心。
5. 样本处理应在生物安全柜中进行,以保护操作人员安全和防止对环境的污染。
6. 每次实验应设置阴性对照和阳性对照,不同批号的试剂请勿混用,在有效期内使用试剂盒。
7. 待测样本尽可能新鲜,提取过程应严防RNA 酶污染及操作不当导致的RNA降解。
8. -70℃保存的RNA样本,加样前应在室温充分融化、混匀并瞬时低速离心后使用。
9. 分装有反应液的反应管应扣盖或装入密实袋内再转移至样本处理区。
10. 加样时应使样品完全加入反应液中,不应有样品粘附于管壁上,加样后应尽快盖紧管盖。
11. 反应液分装时尽量避免产生气泡,上机前注意检查各反应管是否盖紧,避免泄露污染仪器。
12. 扩增完毕取出反应管,密封在专用塑料袋内,丢弃于指定地点。
13. 实验中用过的枪头请直接打入盛有10%次NaClO3的废物缸内,并与其他废弃物品一同丢弃。
14. 工作台及各种实验用物品经常用10%次NaClO3、75%酒精和紫外灯进行消毒。
15. 实时荧光PCR 仪需经常校正和清洁载样板板孔。
16. 本试剂盒涉及的待测样本应视为具有传染性物质,操作和处理均需符合卫生部《微生物生物医学实验室生物安全通用准则》和《医疗废物管理条例》相关要求。
17. 仅供科研使用,不可用于人体及动物的治疗或临床诊断等用途。
本试剂盒用于对人咽拭子样本中甲型流感H1N1亚型病毒核酸进行定性检测。检测结果仅供临床参考,不能单独作为确诊或排除病例的依据。
流感病毒属于正黏病毒科的流感病毒属,依据内部核蛋白与基质蛋白的抗原性差异,可被分为甲、乙、丙三型(即A、B、C 三型)。据病毒颗粒外膜血凝素(HA)和神经氨酸酶(NA)蛋白抗原性的不同,甲型流感病毒可分为16 个H 亚型(H1~H16)和9 个N 亚型(N1~N9)。其中甲型H1N1流行性感冒(流感)是由一种新的流感病毒引起的急性呼吸道传染病, 临床主要表现为流感样症状, 包括发热、流涕、咽痛、咳嗽、头痛和腹泻等。
【检验原理】
本试剂盒选用甲型流感H1N1亚型病毒保守基因片段设计特异引物及特异探针,该探针能与引物扩增区域中间的一段DNA模板发生特异性结合,在PCR延伸反应过程中,Taq酶的外切酶活性将5’端荧光基团从探针上切割下来,使之游离于反应体系中,从而脱离了3’端荧光淬灭基团的屏蔽,即能接受光刺激而发出可供仪器检测的荧光,从而实现在全封闭反应体系中对甲型流感H1N1亚型病毒核酸的自动化检测。
试剂盒中的内标选用一对管家基因特异性引物,结合特异性探针,该探针能与引物扩增区域中间的一段DNA模板发生特异性结合,内标选用CY5通道,从而实现在全封闭反应体系中对检测过程的监控,可有效监控假阴性的发生。
【检验方法】
1. 甲型流感H1N1亚型病毒RNA检测试剂盒可兼容常规RNA提取试剂盒或常规RNA提取方法从待测样本中制备的合格的RNA。制备的RNA可直接作为RNA样品,加入PCR反应体系中。
2. 试剂配制【试剂准备区】
从试剂盒中取出H1N1反应混合液,在室温下融化并振荡混匀后,2000rpm离心10sec,按15μl量分装到PCR反应管中,转移至样本处理区。(注:每次实验必须带阴阳性质控)
3. 加样【样本处理区】
分别加入10 μl的阴性对照、H1N1阳性对照(无需抽提)、样品核酸提取产物,终体积为25μl/管,盖紧反应管,瞬时低速离心,转移至检测区。
4. PCR扩增及荧光检测【PCR检测区】
将各反应管按一定顺序放入PCR仪上,按以下程序进行PCR扩增:

检测荧光选择: H1(FAM),N1(HEX/VIC),内标(CY5),数据采集定在60℃。
*:升温速率6℃/S建议使用抚生系列实时荧光PCR仪,其它仪器根据仪器具体性能选择。
**:其它仪器比如ABI7500采集荧光设定为31s,对结果无影响。
【检验结果的解释】
质量控制
1. 阴性对照:无典型S型扩增曲线。
2. 阳性对照:目标基因通道呈典型S型扩增曲线且Ct值≤30。
3. 在同时满足1、2的条件下,实验有效,否则无效。
结果判读
在满足以上质量控制条件,进行如下分析(FAM通道为H1,HEX/VIC通道为N1,CY5通道为内标):

待测标本检测结果37<Ct<45,此时样本应进行重复检测,如重复检测结果Ct值小于45,曲线呈S型且有明显指数增长期,则判断为阳性,否则判断为阴性。
该测试为无效测试,需要排查原因并重新检测。
【检验方法的局限性】
检测结果不能直接作为临床确诊或排除病例的依据,仅供临床医生参考使用。同时,检测结果和样本的采集、保存及运输条件有关,其中任何环节失误都可导致假阴性结果;如在样本处理过程中发生交叉污染,则可能出现假阳性结果。
【性能指标】
1. 检测限:本试剂盒检测限为500copies/ml。
2. 精密度:两例高、低阳性的样本连续重复10次检测,其Ct值的CV≤5%。
3. 特异性:与其感染部位相同或感染症状相似且常见的其他病原体以及人基因组无交叉反应。
【注意事项】
1. 本试剂盒为体外检测试剂,在使用时操作人员必须经过基因扩增或分子生物学方法检测的专业培训,具有相关的实验操作资格,且其所在实验室应具备合理的生物安全防备设施及防护程序。
2. 为保证实验结果的准确性和可靠性请使用已校准的移液器,选用合格的一次性使用的PCR反应管、离心管、枪头等进行样本处理及配液等操作,所有用具应不含DNA 酶和RNA 酶。
3. 实验请严格分区操作:
第一区:试剂准备区-准备扩增所需试剂;第二区:样本处理区-待检测样本和对照品的处理;第三区:PCR检测区-PCR扩增检测,各区物品均为专用,不得交换使用,避免污染,每次实验完后立即清洁工作台。
4. 本产品使用前应在室温充分融化,混匀并瞬时低速离心。
5. 样本处理应在生物安全柜中进行,以保护操作人员安全和防止对环境的污染。
6. 每次实验应设置阴性对照和阳性对照,不同批号的试剂请勿混用,在有效期内使用试剂盒。
7. 待测样本尽可能新鲜,提取过程应严防RNA 酶污染及操作不当导致的RNA降解。
8. -70℃保存的RNA样本,加样前应在室温充分融化、混匀并瞬时低速离心后使用。
9. 分装有反应液的反应管应扣盖或装入密实袋内再转移至样本处理区。
10. 加样时应使样品完全加入反应液中,不应有样品粘附于管壁上,加样后应尽快盖紧管盖。
11. 反应液分装时尽量避免产生气泡,上机前注意检查各反应管是否盖紧,避免泄露污染仪器。
12. 扩增完毕取出反应管,密封在专用塑料袋内,丢弃于指定地点。
13. 实验中用过的枪头请直接打入盛有10%次NaClO3的废物缸内,并与其他废弃物品一同丢弃。
14. 工作台及各种实验用物品经常用10%次NaClO3、75%酒精和紫外灯进行消毒。
15. 实时荧光PCR 仪需经常校正和清洁载样板板孔。
16. 本试剂盒涉及的待测样本应视为具有传染性物质,操作和处理均需符合卫生部《微生物生物医学实验室生物安全通用准则》和《医疗废物管理条例》相关要求。
17. 仅供科研使用,不可用于人体及动物的治疗或临床诊断等用途。